Örökletes, nem polipózisos vastag- és végbélrák (HNPCC), más néven Lynch szindróma, egy autoszomális domináns genetikai állapot, amely a vastagbélrák, valamint más rákos megbetegedések, köztük az endometriumrák (a második leggyakoribb), a petefészek-, gyomor-, vékonybél-, máj-epeúti, felső húgyúti, agy- és bőrrák kockázatával jár. Ezeknek a ráknak a megnövekedett kockázata az öröklött mutációknak köszönhető, amelyek rontják a DNS-eltérés javítását. Ez a rák szindróma egy fajtája.
Lynch-szindróma tünetei
A rák kockázata
Élethosszig tartó kockázat és átlagos életkor a Lynch-szindrómával összefüggő rákos megbetegedések diagnosztizálásakor
| A rák típusa | Életre szóló kockázat (%) | Átlagéletkor a diagnózis felállításakor (év) |
| Kolorektális | 52-58 | 44-61 |
| Endometrium | 25-60 | 48-62 |
| Gyomor | 6-13 | 56 |
| Petefészek | 4-12 | 42.5 |
A fenti táblázatban található ráktípusokon kívül nyilvánvaló, hogy a Lynch-szindróma hozzájárul a vékonybélrák, a hasnyálmirigyrák, az ureter/vesemedencerák, az epeúti rák, az agyrák és a faggyúdaganatok fokozott kockázatához is. A prosztatarák és a mellrák fokozott kockázatát a Lynch-szindrómával is összefüggésbe hozták, bár ez az összefüggés nem teljesen ismert.
A vastagbélrákok kétharmada a proximális vastagbélben fordul elő, és a gyakori jelek és tünetek közé tartozik a véres széklet, hasmenés vagy székrekedés, valamint a nem kívánt súlyvesztés. A vastag- és végbélrák diagnosztizálásának átlagéletkora 44 év az amszterdami kritériumoknak megfelelő családtagok esetében. Az endometriumrák diagnosztizálásának átlagos életkora körülbelül 46 év. A vastagbél- és méhnyálkahártyarákban is szenvedő HNPCC-ben szenvedő nők körülbelül fele először endometriumrákban szenved, így a méhnyálkahártya-rák a leggyakoribb őrszemrák a Lynch-szindrómában. Az endometriumrák leggyakoribb tünete a kóros hüvelyi vérzés. A HNPCC-ben a gyomorrák diagnosztizálásának átlagos életkora 56 év, és a béltípusú adenokarcinóma a leggyakrabban jelentett patológia. A HNPCC-vel összefüggő petefészekrákok diagnosztizálásának átlagos életkora 42,5 év; körülbelül 30%-át 40 éves kor előtt diagnosztizálják.
A rák arányában jelentős eltéréseket találtak az érintett mutációtól függően. 75 éves korig a vastagbélrák, az endometriumrák, a petefészekrák, a felső gyomor-bélrendszeri (gyomor-, nyombél-, epevezeték- vagy hasnyálmirigy-), húgyúti rák, prosztatarák és agydaganatok kockázata a következő volt: MLH1 mutációk esetén a kockázat 46%, 43%, 10%, 21%, 8%, 17% és 1% volt; az MSH2 mutációk esetében a kockázat 57%, 17%, 10%, 25%, 32% és 5% volt; az MSH6 mutációk esetében a kockázat 15%, 46%, 13%, 7%, 11%, 18% és 1% volt.
| Gén | Petefészekrák kockázata | Endometriumrák kockázata |
|---|---|---|
| MLH1 | 4-24% | 25-60% |
| MSH2/EPCAM | 4-24% | 25-60% |
| MSH6 | 1-11% | 16-26% |
| PMS2 | 6% (kombinált kockázat) | 15% |
Genetika

A HNPCC autoszomális domináns módon öröklődik. A HNPCC jellemzője a hibás DNS-hibás illeszkedés javítása, amely megnövekedett egyetlen nukleotid változást és mikroszatellit instabilitást okoz, más néven MSI-H (a H „magas”). Az MSI a patológiai laboratóriumban azonosítható a rákos mintákban. A legtöbb esetben megváltozik a citozin és adenin nukleobázisok dinukleotid ismétlődéseinek hossza (szekvencia: CACACACACA…).
A HNPCC-ben részt vevő 4 fő gén általában olyan fehérjéket kódol, amelyek működésükhöz dimereket képeznek:
- Az MLH1 fehérje dimerizálódik a PMS2 fehérjével, és MutLα képződik, amely koordinálja a hibás illeszkedés javításában részt vevő egyéb fehérjék, például a DNS-helikáz, az egyszálú DNS-kötő fehérje (RPA) és a DNS-polimerázok kötődését.
- Az MSH2 fehérje dimerizálódik az MSH6 fehérjével, amely az eltéréseket egy csúszó bilincs-modell segítségével azonosítja, amely egy fehérje a hibák keresésére.
A fehérje dimer bármelyik génjének károsodása rontja a fehérje működését. Ez a 4 gén részt vesz a hibajavításban (mismatch repair), így a gének diszfunkciója a DNS-replikációs hibák kijavításának képtelenségéhez és HNPCC-hez vezethet. A HNPCC köztudottan más mutációkkal is összefüggésbe hozható a DNS-hibát javító útvonalban részt vevő génekben:
| OMIM név | A HNPCC-ben érintett gének | A mutációk gyakorisága a HNPCC családokban | Locus | Első publikáció |
|---|---|---|---|---|
| HNPCC1 (120435) | MSH2/EPCAM | körülbelül 60% | 2p22 | Fishel 1993 |
| HNPCC2 (609310) | MLH1 | körülbelül 30% | 3p21 | Papadopoulos 1994 |
| HNPCC5 | MSH6 | 7-10% | 2p16 | Miyaki 1997 |
| HNPCC4 | PMS2 | viszonylag ritka | 7p22 | Nicolaides 1994 |
| HNPCC3 | PMS1 | esetleírás | 2q31-q33 | Nicolaides 1994 |
| HNPCC6 | TGFBR2 | esetleírás | 3p22 | |
| HNPCC7 | MLH3 | vitatott | 14q24.3 |
A legtöbb HNPCC-ben szenvedő ember ezt az állapotot egy szülőtől örökli. A hiányos penetrancia, a rák diagnosztizálásának változó kora, a rák kockázatának csökkenése vagy a korai halálozás miatt azonban nem minden HNPCC génmutációban szenvedő embernek van rákos szülője. Vannak, akiknél a HNPCC de-novo egy új generációban alakul ki, anélkül, hogy a gént örökölnék. Ezeket az embereket gyakran csak egy korai vastagbélrák kialakulása után azonosítják. A HNPCC-ben szenvedő szülőknek 50% az esélyük arra, hogy a genetikai mutációt minden gyermekre átadják. Azt is fontos megjegyezni, hogy az egyik MMR-gén káros mutációja önmagában nem elegendő a rák kialakulásához, hanem más tumorszuppresszor gének további mutációira van szükség.
Lynch-szindróma diagnózisa
A Lynch-szindróma diagnózisát olyan betegeknél alkalmazzák, akiknél a genetikai vizsgálattal azonosított MMR-gén (MLH1, MSH2, MSH6 és PMS2) vagy az EPCAM-gén csíravonal-DNS-mutációja van. A csíravonal genetikai vizsgálatára jelöltek azonosíthatók olyan klinikai kritériumok alapján, mint az Amsterdam Clinical Criteria és a Bethesda-irányelvek, vagy immunhisztokémiai (IHC) vagy mikroszatellit-instabilitási (MSI) vizsgálattal végzett tumoranalízis. Az Egyesült Államokban a szakmai társaságok azt javasolják, hogy minden vastagbélrákot MSI-re vagy IHC-re teszteljenek Lynch-szindróma szűréseként, de ezt nem mindig végzik el a költségek és az erőforrások korlátozottsága miatt. A genetikai vizsgálat kereskedelmi forgalomban kapható, és vérvizsgálatból áll.
Immunhisztokémia
Az immunhisztokémia (IHC) egy olyan módszer, amellyel kimutatható a kóros eltérés-javító (MMR) fehérje expresszió Lynch-szindrómával összefüggő daganatokban. Bár nem a Lynch-szindróma diagnosztizálása, szerepet játszhat azon személyek azonosításában, akiknél csíravonal-vizsgálatot kell végezni. Az IHC-teszt két megvalósítási módja magában foglalja az életkoron alapuló tesztelést és az egyetemes tesztelést minden ember számára. Jelenleg nincs széles körű egyetértés abban, hogy melyik szűrési módszert kell alkalmazni. Az IHC életkoron alapuló tesztelését részben a költség-haszon elemzések miatt javasolták, míg a vastagbélrákos betegek egyetemes vizsgálata biztosítja, hogy a Lynch-szindrómás betegek ne maradjanak le. A költségek kezelése érdekében a kutatók az MSI-t vagy az IHC-t közvetlenül a daganat mikroszkóp alatti megjelenése alapján próbálják megjósolni, anélkül, hogy molekuláris vizsgálatokat végeznének.
Mikroszatellit instabilitás
A DNS-hibát javító rendszerek mutációi nehézségeket okozhatnak a DNS-en belüli olyan régiók átvitelében, amelyek két vagy három nukleotidból álló ismétlődő mintákat (mikrosatelliteket) tartalmaznak, más néven mikroszatellit instabilitás (MSI). Az MSI azonosítása DNS-kivonás útján történik mind a tumorszövetből, mind a normál szövetmintából, majd a mikroszatellit régiók PCR-elemzésével. Az MSI-elemzés felhasználható a Lynch-szindrómában szenvedő személyek azonosítására, és további vizsgálatokra irányíthatja őket.
Osztályozás
Az MSI-H (mikroszatellit instabilitás – MSI) rákos megbetegedések három fő csoportja ismerhető fel kórszövettani kritériumok alapján:
- jobb oldali rosszul differenciált rákos megbetegedések
- jobb oldali mucinosus daganatok
- adenokarcinómák bármely helyen, ahol az intraepiteliális limfocita (TIL) mérhető szintje látható
A kórszövettani kritériumok nem elég érzékenyek az MSI szövettanból történő kimutatására, de a kutatók mesterséges intelligencia segítségével próbálják megjósolni az MSI-t a szövettanból.
Ezenkívül a HNPCC felosztható Lynch I-szindrómára (családi vastagbélrák) és Lynch II-szindrómára (HNPCC, amely a gyomor-bél traktus vagy a reproduktív rendszer egyéb rákos megbetegedéseivel társul).
Megelőzés
Szűrővizsgálat
Az amszterdami kritériumoknak megfelelő családok számára genetikai tanácsadás és genetikai vizsgálat javasolt, lehetőleg a vastagbélrák kialakulása előtt.
Vastagbél rák
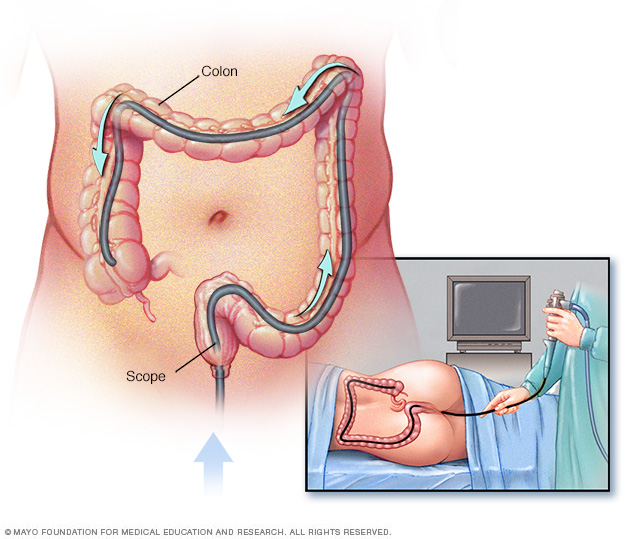
A kolonoszkópia a Lynch-szindrómában vagy az LS-hez kapcsolódó génekben szenvedő egyének megelőző megfigyelési módszereként javasolt. Pontosabban, a kolonoszkópiát az MLH1 és MSH2 mutációhordozók esetében 20–25 éves korban, az MSH6 és PMS2 mutációhordozók esetében pedig 35 éves korban javasolt elkezdeni. Ezután a Lynch-szindrómás betegeknél 1-2 éves időközönként kolonoszkópos megfigyelést kell végezni.
Endometrium/petefészekrák
A petefészek- és méhnyálkahártyarák-szűréshez évente ajánlott egy transzvaginális ultrahang endometrium biopsziával vagy anélkül. Lynch-szindrómás nők esetében évente CA-125 vérvizsgálat használható a petefészekrák szűrésére, azonban korlátozott mennyiségű adat áll rendelkezésre ennek a tesztnek a mortalitás csökkentésében való hatékonyságáról.
Egyéb rákos megbetegedések
Vannak stratégiák más rákos megbetegedések korai felismerésére vagy a kifejlődésük esélyének csökkentésére, amelyeket a Lynch-szindrómás betegek megbeszélhetnek orvosukkal, azonban ezek hatékonysága nem egyértelmű. Ezek a lehetőségek a következők:
- Felső endoszkópia gyomor- és vékonybélrák kimutatására 3-5 évente, legkorábban 30 éves kortól (lehetőleg kutatási környezetben)
- Éves vizeletvizsgálat a hólyagrák kimutatására, legkorábban 30 éves kortól (lehetőleg kutatási környezetben)
- Éves fizikai és neurológiai vizsgálatok a központi idegrendszeri (agyi vagy gerincvelői) rák kimutatására, legkorábban 25 éves kortól
Amszterdam kritériumai
A következők az amszterdami kritériumok a molekuláris genetikai tesztelés magas kockázatú jelöltjeinek azonosítására:
Amsterdam I. kritérium (minden felsoroláspontnak teljesülnie kell):
- Három vagy több családtag, akiknek megerősített diagnózisa vastag- és végbélrák, akik közül az egyik a másik kettő elsőfokú rokona (szülő, gyermek, testvér)
- Két egymást követő érintett generáció
- Egy vagy több vastagbélrák, amelyet 50 éves kor alatt diagnosztizáltak
- A familiáris adenomatosus polyposis (FAP) kizárásra került
Az Amsterdam II kritériumokat 1999-ben dolgozták ki, és javították a Lynch-szindróma diagnosztikai érzékenységét az endometrium, a vékonybél, az ureter és a vesemedence daganatainak bevonásával.
Amszterdam II. kritérium (minden felsoroláspontnak teljesülnie kell):
- Három vagy több HNPCC-vel összefüggő rákos megbetegedésben szenvedő családtag, akik közül az egyik a másik kettő elsőfokú rokona
- Két egymást követő érintett generáció
- A HNPCC-vel összefüggő rákbetegségek közül egy vagy több, amelyet 50 év alatt diagnosztizáltak
- A familiáris adenomatosus polyposis (FAP) kizárásra került
Sebészet
Profilaktikus méheltávolítás és salpingo-oophorectomia (a méh, a petevezeték és a petefészkek eltávolítása a rák kialakulásának megakadályozása érdekében) még a petefészek- vagy méhnyálkahártyarák kialakulása előtt elvégezhető.
Lynch-szindróma kezelése
A sebészet továbbra is a HNPCC első számú terápiája. Azokat a Lynch-szindrómában szenvedő betegeket, akiknél vastag- és végbélrák alakul ki, vagy részleges colectómiával, vagy teljes colectómiával lehet kezelni ileorectalis anasztomózissal. A részleges colectómia utáni vastagbélrák fokozott kockázata és mindkét műtét után hasonló életminőség miatt a teljes colectomia előnyös kezelés lehet a HNPCC-ben, különösen fiatalabb betegeknél.
Folyamatos vita folyik az 5-fluorouracil-alapú adjuváns terápiák előnyeiről a HNPCC-vel összefüggő colorectalis daganatok esetében, különösen az I. és II.
- Az anti-PD-1 antitestterápia hatásos lehet.
Az anti-PD-1 terápiával végzett ellenőrzőpont blokád ma már előnyben részesített első vonalbeli terápia az előrehaladott mikroszatellit-instabilitás – magas vastagbélrák esetén.









Discussion about this post